O trabalho enquadra-se numa linha de investigação mais alargada para compreender como o sistema imunitário mantém o equilíbrio, um tema distinguido pelo Prémio Nobel de Fisiologia ou Medicina deste ano, atribuído a descobertas sobre a tolerância imunitária.
“O intestino não é apenas um tubo que digere os alimentos, é um órgão extremamente ativo, onde os sistemas nervoso e imunitário estão em permanente comunicação”, afirma Henrique Veiga-Fernandes, autor sénior do estudo e Investigador Principal do Laboratório de Imunofisiologia na FC. Publicado na Nature Immunology, o estudo não só identifica um diálogo a três - entre o sistema nervoso, as células epiteliais que o revestem e o sistema imunitário, anteriormente desconhecido no intestino, como também descodifica a linguagem molecular que torna essa comunicação possível.
Matar ou Reparar?
Esta história começou com uma pergunta simples: como é que o sistema imunitário sabe quando deve atacar ou reparar?
“O (nosso) sistema imunitário tem essencialmente de desempenhar duas funções opostas”, explica Veiga-Fernandes. “Eliminar células infetadas ou tumorais, mas também promover a reparação e regeneração quando os tecidos estão danificados. Queríamos compreender como é que o organismo decide entre estes dois caminhos tão diferentes.”
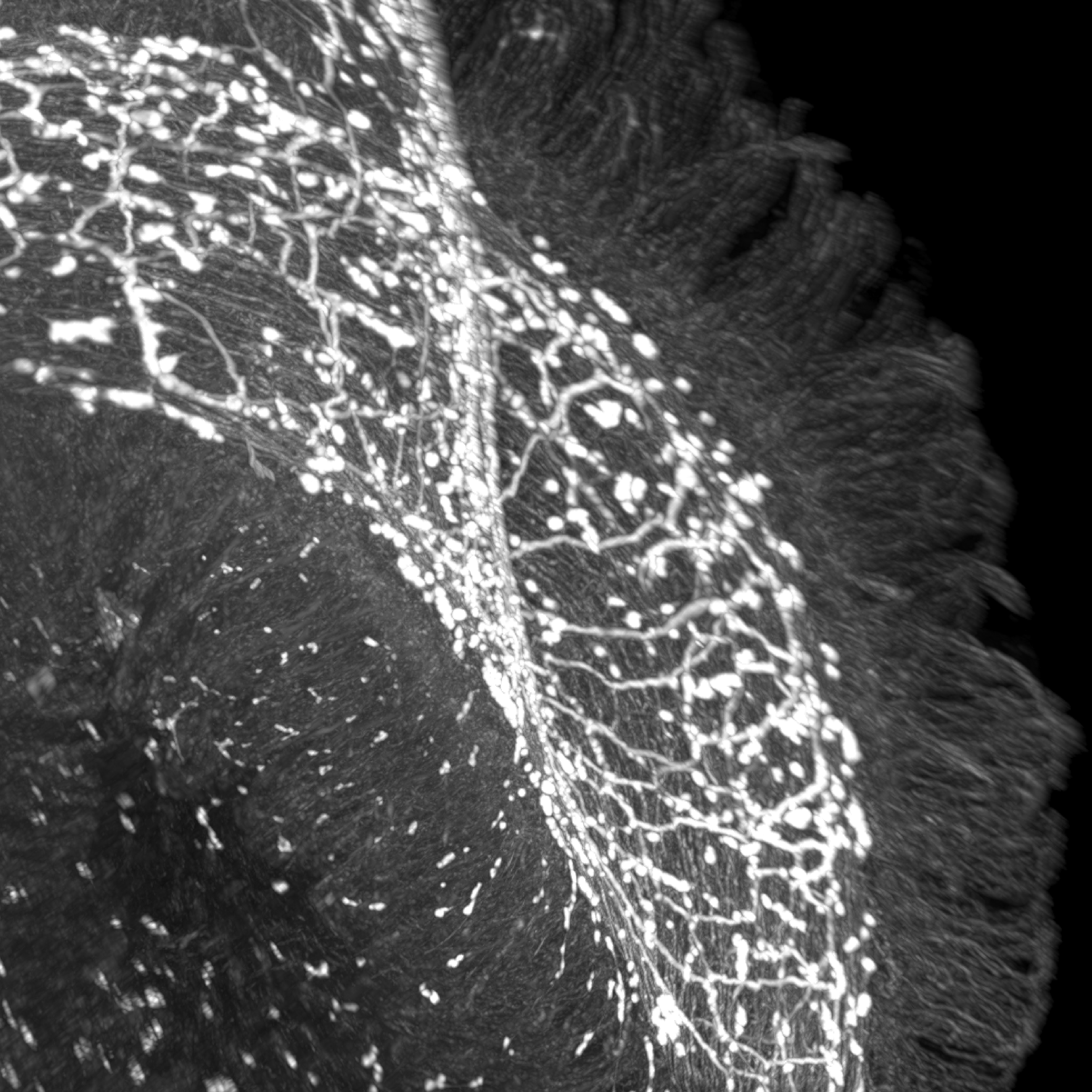
Os investigadores focaram-se num mensageiro neuroquímico chamado VIP - sigla em inglês de peptídeo vasointestinal (vasoactive intestinal peptide) que é libertado por determinados neurónios do intestino. Descobriram que células epiteliais vizinhas possuem um receptor para o VIP, chamado VIPR1, que funciona como uma antena recetora. Estas células epiteliais constituem a primeira linha de defesa do organismo face ao mundo exterior, estando constantemente expostas a alimentos, microrganismos e potenciais agentes patogénicos.
Os Comandos do Intestino
Quando, nas suas experiências em ratinhos, a equipa ativou os neurónios que libertam o VIP, as células epiteliais do intestino começaram a produzir citocinas que estimularam uma resposta imunitária de tipo 1: o “modo de ataque” do organismo, utilizado para destruir bactérias e células infetadas ou células tumorais. Mas, quando bloquearam o receptor VIPR1 nas células epiteliais, houve uma reação inversa: a resposta de tipo 1 enfraqueceu, enquanto a resposta imunitária de tipo 2, aquela que é responsável pela reparação dos tecidos e pelo combate aos parasitas, tornou-se mais forte.
A mudança foi impressionante. Os ratinhos sem VIPR1 nas suas células epiteliais tornaram-se mais vulneráveis a infeções bacterianas, como a Salmonela, mas mais resistentes a parasitas. “Esta foi a grande surpresa”, afirma Roksana Pirzgalska, primeira autora do estudo. “Percebemos que os neurónios do intestino não se limitam a ajustar a imunidade localmente, mas que também coordenam programas imunitários completamente diferentes.”
Por outras palavras, o sistema nervoso do intestino atua como agulhas em carris, analisando o ambiente e decidindo qual o percurso que o sistema imunitário deve seguir. Quando o “carril de ataque” está ativo, as células imunitárias percorrem o revestimento intestinal e eliminam bactérias e células tumorais. Quando o “carril de reparação” é acionado, o mesmo tecido concentra-se na regeneração, reconstruindo a delicada barreira epitelial que mantém os microrganismos nocivos no exterior.
Mas como é que as células epiteliais transmitem a mensagem depois de receberem o sinal do VIP? “Descobrimos que estas células traduzem o sinal nervoso num conjunto de instruções moleculares, um cocktail de citocinas, mensageiros químicos que atuam no sistema imunitário”, explica Pirzgalska. “Podemos pensar nas citocinas como a linguagem que as células epiteliais usam para comunicar com as células imunitárias. Diferentes células imunitárias possuem diferentes receptores para estas citocinas, por isso, dependendo de quais são libertadas, o sistema imunitário sabe se deve atacar ou reparar.”
Doenças Civilizacionais
A equipa descobriu que este interruptor neuronal está intimamente ligado ao comportamento alimentar e, por conseguinte, aos nossos ritmos biológicos diários. Comer estimula a produção do neuropeptídeo VIP, o que, do ponto de vista evolutivo, faz sentido: cada refeição traz o risco de ingestão de agentes infeciosos, pelo que ativar o “carril de ataque” nesse momento ajuda a proteger o intestino.
“O problema”, afirma Veiga-Fernandes, “é que a vida moderna perturbou estes ritmos. Quando as pessoas comem tarde ou trabalham em turnos ou horários irregulares, mantêm o sistema imunitário constantemente em ‘modo de ataque’. Isso significa que o intestino não consegue ter o seu período normal de descanso e reparação.”
Isto, acrescenta o autor, poderá contribuir para um aumento das chamadas “doenças civilizacionais”, como a inflamação crónica, os distúrbios metabólicos e o cancro. “Os nossos resultados sugerem que, quando os ritmos circadianos e os padrões alimentares estão desencontrados, o interruptor neuro-imunitário do intestino pode estar desajustado, impedindo que o intestino se regenere adequadamente.”
Dos Ratinhos aos Humanos, e Para Além do Intestino
Embora as experiências tenham sido realizadas em ratinhos, os investigadores confirmaram que as células epiteliais intestinais humanas também expressam o receptor VIPR1, sugerindo que o mesmo sistema de comunicação neuro-epitelial existe nos humanos. Médicos do Centro Clínico Champalimaud, entre os quais o gastrenterologista Ricardo Rio-Tinto, ajudaram a validar estes resultados em células e tecidos humanos.
“Esta é a primeira prova clara de que os neurónios do intestino, que respondem a sinais comportamentais como a alimentação, podem coordenar diretamente as respostas imunitárias através das células epiteliais, não apenas localmente, mas a nível de todo o organismo”, afirma Veiga-Fernandes. “É um excelente exemplo de como o comportamento e a imunidade estão profundamente interligados”, acrescenta Pirzgalska.
A equipa de Veiga-Fernandes está agora a investigar como os sinais do cérebro interagem com os circuitos neuro-epiteliais ao longo do chamado eixo cérebro-corpo, e que mecanismos semelhantes às “agulhas dos carris” poderá o sistema nervoso estar a operar noutros órgãos, especialmente no contexto do cancro e da obesidade. “É cada vez mais evidente que nada no nosso corpo funciona isoladamente”, afirma. “O sistema nervoso, o sistema imunitário, o microbioma, o metabolismo, todos estão em diálogo contínuo, dia e noite.”
Por isso, da próxima vez que lhe apetecer comer um lanchinho à meia-noite, lembre-se dos silenciosos “comboios” no seu intestino, a mudar de carril no escuro.
Artigo original aqui.
Imagem: Neurónios da parede intestinal que produzem VIP, um neuropeptídeo que ajuda a regular as respostas imunitárias.
Texto por Hedi Young, Science Writer and Content Creator da Equipa de Comunicação, Eventos & Outrecah da Fundação Champalimaud.